发展特异性强、敏感度高的影像诊断手段对肿瘤的早期发现和治疗具有重要意义。磁共振对比剂的弛豫率是评价其性能的主要参数之一。目前临床在用的磁共振成像(MRI)对比剂均为钆(Gd)基的小分子药物。考虑到游离钆离子的毒性,这类Gd离子螯合物的药物通常因Gd离子配位的稳定性而牺牲了离子与水配位的能力,弛豫性能也受之影响。近年来发展合成的Gd基纳米晶虽能很好的约束Gd离子的泄露,但其结晶性往往也限制了晶体内部Gd离子与水配位的能力,大大降低了Gd离子的利用率,材料的弛豫率也受限于此。
针对该问题,研究人员尝试直接设计制备高含水的Gd基材料,以期提升Gd离子与水互动的可能性。近日,中国科学技术大学俞书宏院士团队与合肥工业大学陆杨教授研究组、康斯坦茨大学Helmut Cölfen教授团队合作,在Nature Communications上在线发表了题为“Highly hydrated paramagnetic amorphous calcium carbonate nanoclusters as an MRI contrast agent”的研究论文,报道了一种新型的高性能磁共振成像对比剂,这是一种可宏量制备的顺磁性无定形钆掺杂碳酸钙纳米簇。合肥微尺度物质科学国家研究中心特聘副研究员董良(现为中国科学院杭州基础医学与肿瘤研究所特聘研究员)、中国科大附属第一医院影像科主任医师徐运军、隋聪博士为该论文的共同第一作者。
在自然界中,无定形碳酸钙是广泛存在的具有高含水的一种矿化中间产物,但其稳定性差,很容易失水结晶变为其他晶型。研究人员运用仿生矿化策略,发展了一种可宏量制备的无定形钆掺杂碳酸钙的快速合成方法,成功将碳酸盐的生长稳定在无定形亚稳态,制备出一种超小尺寸的纳米簇(amorphous carbonate nanoclusters, ACNC)(图1a-e)。钆离子稳定的掺入到无定形碳酸钙中,赋予该纳米簇顺磁性(图1f),为该思路设计的磁共振对比剂的开发及应用奠定了基础。因碳酸钙内环境的限域作用,该纳米簇有效防止了钆离子的泄露,克服了钆基对比剂在体内环境稳定性不足的问题。
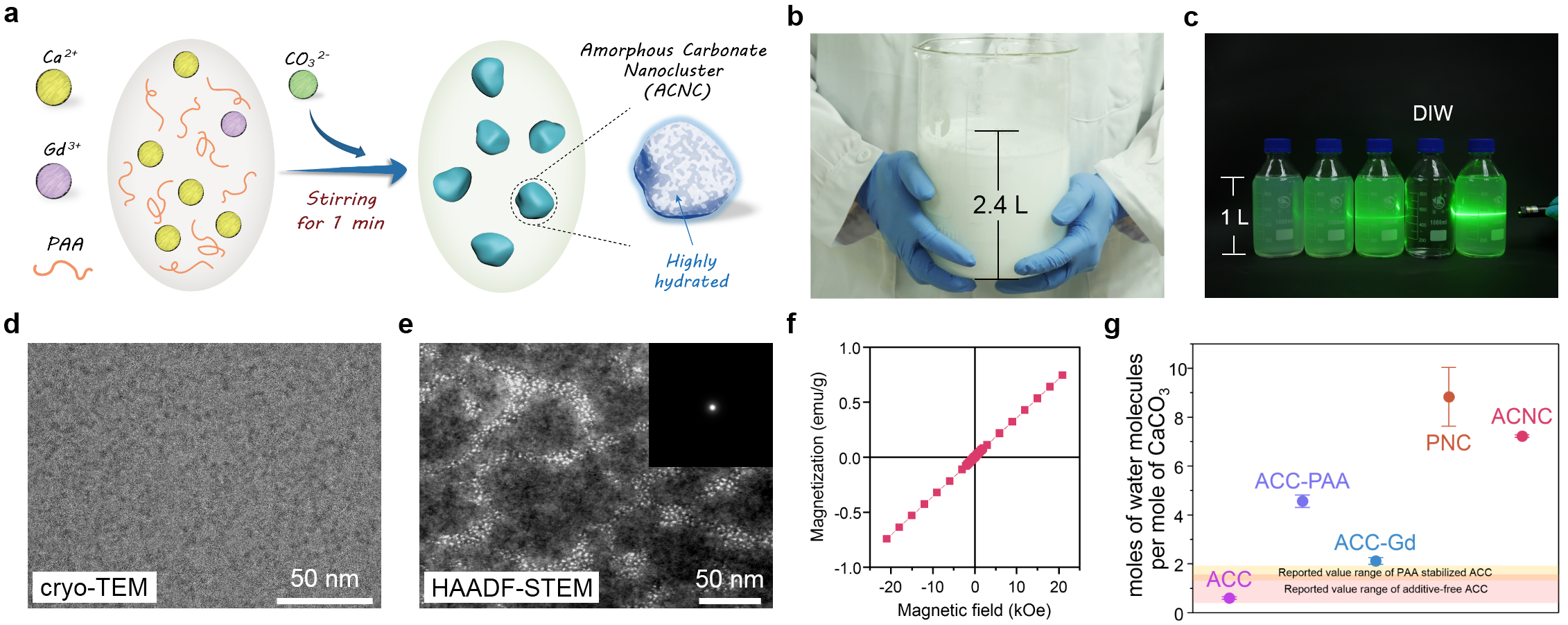
图1. a-f无定形钆掺杂碳酸钙纳米簇(ACNC)的制备示意图和相关表征;g文献报道的无定形碳酸钙及其他合成样品对照与ACNC的含水量的对比。
高内含水量是无定形碳酸钙的自身特色,经研究人员设计合成的超小无定形钆掺杂碳酸钙纳米簇的含水量(水/钙摩尔比=7.2)相较于已报道的人工合成的无定形碳酸钙(水/钙摩尔比范围为0.4-1.93)又提升了几倍(图1g)。因纳米簇极高的含水量,该纳米磁共振对比剂的纵向摩尔弛豫率(r1)大幅度提升至37.21 mM-1s-1,约是目前临床使用磁共振对比剂钆喷酸葡胺注射液(Gd-DTPA)的12倍(研究中同条件下r1检测为3.19 mM-1s-1)。
研究人员在大鼠、新西兰兔、比格犬等多种实验动物上,借助磁共振对比增强血管造影(Contrast enhanced MR angiography, CE-MRA)技术,将纳米对比剂ACNC与当前临床用对比剂Gd-DTPA的成像效果进行比较。结果显示新型纳米对比剂能在更低的剂量下展现出更清晰、更优异的对比增强效果(图2)。尤其是在对细微小血管和组织的细节成像上,优势较目前临床用对比剂更为明显,更有利于临床上心脑血管疾病和肿瘤性病变的诊断。研究人员同时研究了该纳米簇在多种生理环境条件下的稳定性与生物相容性,评估了其体内快速清除、体内代谢分布和体内安全性,为实现其临床转化提供了重要的信息和依据。

图2. 在多种实验动物模型上(a大鼠,b兔子,c比格犬),(i)临床用钆喷酸葡胺注射液(Gd-DTPA)及(ii)无定形钆掺杂碳酸钙纳米簇(ACNC)的磁共振血管成像(MRA)效果与(d)对比增强MRA的信噪比(signal-noise ratio, SNR)的比较。
该纳米簇因其自身超高的内含水量和稳定性,在临床磁共振成像3.0 T磁场下展现出超高的纵向弛豫率(r1=37.93 mM-1s-1)和优异的体内血池造影效果,其弛豫率是当下临床用磁共振对比剂钆喷酸葡胺注射液(gadopentetic acid, Gd-DTPA)的十倍以上,展现出重要的临床应用价值。此外,该材料可以快速宏量制备,在常温常压条件下,几分钟可生产出几升材料,这为其临床应用转化提供了保障。这种无定形钆掺杂碳酸钙的快速合成方法为今后新型纳米磁共振成像对比剂的研制提供了新的途径。
该工作得到了国家重点研发计划项目、国家自然科学基金重点项目、安徽省科技重大专项、“科大新医学”联合基金等资助。
文章链接:https://doi.org/10.1038/s41467-022-32615-3
(合肥微尺度物质科学国家研究中心、化学与材料科学学院、科研部)
